Corrosiebestendigheid van metalen
Wat is corrosiebestendigheid?
Het vermogen van een metaal om corrosie te weerstaan wordt corrosieweerstand genoemd. Dit vermogen wordt bepaald door de corrosiesnelheid onder bepaalde omstandigheden. Kwantitatieve en kwalitatieve kenmerken worden gebruikt om de mate van corrosie te beoordelen.

De kwalitatieve kenmerken zijn:
-
het uiterlijk van het metalen oppervlak veranderen;
-
verandering in de microstructuur van het metaal.
De kwantitatieve kenmerken zijn:
-
tijd vóór het verschijnen van de eerste corrosiehaard;
-
het aantal gevormde corrosiehaarden gedurende een bepaalde periode;
-
metaalverdunning per tijdseenheid;
-
verandering in massa van metaal per oppervlakte-eenheid per tijdseenheid;
-
het volume gas dat tijdens corrosie wordt geabsorbeerd of vrijkomt per oppervlakte-eenheid per tijdseenheid;
-
elektrische stroomdichtheid voor een gegeven corrosiesnelheid;
-
verandering van eigenschappen in de loop van de tijd (mechanische eigenschappen, reflectiviteit, elektrische weerstand).
Verschillende metalen hebben verschillende weerstand tegen corrosie.Om de corrosieweerstand te verhogen, worden speciale methoden gebruikt: legeren voor staal, verchromen, aluminiseren, vernikkelen, schilderen, verzinken, passiveren, enz.
Ijzer en staal

In aanwezigheid van zuurstof en zuiver water corrodeert ijzer snel, de reactie verloopt volgens de formule:
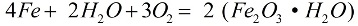
Tijdens het corrosieproces bedekt een losse laag roest het metaal, en deze laag beschermt het helemaal niet tegen verdere vernietiging, corrosie gaat door totdat het metaal volledig is vernietigd. De actievere corrosie van ijzer wordt veroorzaakt door zoutoplossingen: als er ook maar een klein beetje ammoniumchloride (NH4Cl) in de lucht aanwezig is, gaat het corrosieproces veel sneller. In een zwakke oplossing van zoutzuur (HCl) zal de reactie ook actief verlopen.
Salpeterzuur (HNO3) in een concentratie van meer dan 50% leidt tot passivering van het metaal — het wordt bedekt met een beschermende laag, zij het kwetsbaar. Verdampt salpeterzuur is veilig voor ijzer.
Zwavelzuur (H2SO4) in een concentratie van meer dan 70% passiveert ijzer, en als staalklasse St3 wordt opgeslagen in 90% zwavelzuur bij een temperatuur van 40 ° C, dan zal onder deze omstandigheden de corrosiesnelheid niet hoger zijn dan 140 micron per jaar. Als de temperatuur 90 ° C is, zal de corrosie 10 keer sneller doorgaan. Zwavelzuur met een ijzerconcentratie van 50% lost op.
Fosforzuur (H3PO4) zal ijzer niet aantasten, noch watervrije organische oplosmiddelen zoals alkalische oplossingen, waterige ammoniak, droog Br2 en Cl2.
Als je een duizendste natriumchromaat aan water toevoegt, wordt het een uitstekende ijzercorrosieremmer, net als natriumhexametafosfaat. Maar chloorionen (Cl-) verwijderen de beschermlaag van het strijkijzer en verhogen de corrosie.Het ijzer is technisch zuiver, bevat ongeveer 0,16% onzuiverheden en is zeer goed bestand tegen corrosie.
Middelgelegeerde en laaggelegeerde staalsoorten
Legeringstoevoegingen van chroom, nikkel of koper in laaggelegeerde en middelgelegeerde staalsoorten verhogen hun weerstand tegen water- en atmosferische corrosie. Hoe meer chroom, hoe hoger de oxidatieweerstand van het staal. Maar als het chroom minder dan 12% is, zullen chemisch actieve media een destructief effect hebben op dergelijk staal.
Hooggelegeerde staalsoorten
In hooggelegeerde staalsoorten zijn de legeringscomponenten meer dan 10%. Als het staal 12 tot 18% chroom bevat, dan is dergelijk staal bestand tegen contact met bijna alle organische zuren, met voedsel, zal het bestand zijn tegen salpeterzuur (HNO3), basen, veel zoutoplossingen. In 25% mierenzuur (CH2O2) zal hooggelegeerd staal corroderen met een snelheid van ongeveer 2 mm per jaar. Sterke reductiemiddelen, zoutzuur, chloriden en halogenen zullen echter hooggelegeerd staal vernietigen.
Roestvrij staal dat 8 tot 11% nikkel en 17 tot 19% chroom bevat, is beter bestand tegen corrosie dan staal met een hoog chroomgehalte alleen.Dergelijke staalsoorten zijn bestand tegen zure oxiderende media, zoals chroomzuur of salpeterzuur, evenals sterke alkaliën.
Nikkel als additief verhoogt de weerstand van het staal tegen niet-oxiderende omgevingen en tegen atmosferische factoren. Maar de omgeving is zuur, reducerend en zuur met halogeenionen, - ze zullen de passiverende oxidelaag vernietigen, waardoor het staal zijn weerstand tegen zuren verliest.
Roestvrij staal met toevoeging van molybdeen in een hoeveelheid van 1 tot 4% heeft een hogere corrosieweerstand dan chroom-nikkelstaal.Molybdeen geeft weerstand tegen zwavelzuur en zwavelzuur, organische zuren, zeewater en halogeniden.
Ferrosilicium (ijzer met een toevoeging van 13 tot 17% silicium), het zogenaamde ijzer-silicium gietstuk, is corrosiebestendig door de aanwezigheid van een oxidefilm van SiO2 en kan noch zwavel-, noch salpeter-, noch chroomzuur vernietigen, ze versterken alleen deze beschermende film. Maar zoutzuur (HCl) zal ferrosilicium gemakkelijk aantasten.
Nikkellegeringen en puur nikkel

Nikkel is bestand tegen vele factoren, zowel atmosferisch als laboratorium, tegen schoon en zout water, tegen alkalische en neutrale zouten zoals carbonaten, acetaten, chloriden, nitraten en sulfaten. Niet-geoxygeneerde en niet-hete organische zuren zijn niet schadelijk voor nikkel, evenals kokend geconcentreerd alkalisch kaliumhydroxide (KOH) in een concentratie tot 60%.
Corrosie wordt veroorzaakt door reducerende en oxiderende media, oxiderende alkalische of zure zouten, oxiderende zuren zoals stikstof, vochtige gasvormige halogenen, stikstofoxiden en zwaveldioxide.
Monelmetaal (tot 67% nikkel en tot 38% koper) is zuurbestendiger dan puur nikkel, maar is niet bestand tegen de werking van sterk oxiderende zuren. Het verschilt in vrij hoge weerstand tegen organische zuren, tegen een aanzienlijke hoeveelheid zoutoplossingen. Atmosferische en watercorrosie vormen geen bedreiging voor monelmetaal; fluoride is ook veilig voor hem. Monel-metaal is veilig bestand tegen 40% kokend waterstoffluoride (HF) zoals platina.
Aluminiumlegeringen en puur aluminium

De beschermende oxidefilm van aluminium maakt het bestand tegen gewone oxidatiemiddelen, azijnzuur, fluor, alleen de atmosfeer en een aanzienlijke hoeveelheid organische vloeistoffen.Technisch zuiver aluminium, waarin de onzuiverheden minder dan 0,5% bedragen, is zeer goed bestand tegen de werking van waterstofperoxide (H2O2).
Het wordt vernietigd door de werking van bijtende basen in een sterk reducerende omgeving. Verdund zwavelzuur en oleum zijn niet verschrikkelijk voor aluminium, maar zwavelzuur van gemiddelde sterkte zal het vernietigen, net als heet salpeterzuur.
Zoutzuur kan de beschermende oxidefilm van aluminium aantasten. Contact van aluminium met kwik of kwikzouten is destructief voor de eerste.
Zuiver aluminium is beter bestand tegen corrosie dan bijvoorbeeld duraluminiumlegering (waarin tot 5,5% koper, 0,5% magnesium en tot 1% mangaan), die minder goed bestand is tegen corrosie. Silumin (toevoeging van 11 tot 14% silicium) is in dit opzicht stabieler.
Koperlegeringen en puur koper

Zuiver koper en zijn legeringen corroderen niet in zout water of lucht. Koper is niet bang voor corrosie: verdunde basen, droge NH3, neutrale zouten, droge gassen en de meeste organische oplosmiddelen.
Legeringen zoals brons, die veel koper bevatten, zijn bestand tegen blootstelling aan zuren, zelfs koud geconcentreerd of heet verdund zwavelzuur, of geconcentreerd of verdund zoutzuur bij kamertemperatuur (25°C).
Bij afwezigheid van zuurstof corrodeert koper niet in contact met organische zuren. Noch fluor, noch droog waterstoffluoride heeft een destructief effect op koper.
Maar koperlegeringen en puur koper worden gecorrodeerd door verschillende zuren als er zuurstof aanwezig is, evenals in contact met nat NH3, sommige zure zouten, natte gassen zoals acetyleen, CO2, Cl2, SO2. Koper reageert gemakkelijk met kwik Messing (zink en koper) is niet erg goed bestand tegen corrosie.
Bekijk hier meer details — Koper en aluminium in de elektrotechniek
Puur zink

Net als schone lucht tast schoon water zink niet aan. Maar als er zouten, koolstofdioxide of ammoniak in water of lucht zijn, begint de corrosie van zink. Zink lost vooral snel op in basen - in salpeterzuur (HNO3), langzamer - in zoutzuur en zwavelzuur.
Organische oplosmiddelen en aardolieproducten hebben over het algemeen geen corrosief effect op zink, maar als het contact langdurig is, bijvoorbeeld met gekraakte benzine, zal de zuurgraad van de benzine toenemen omdat deze in de lucht oxideert en zal corrosie van het zink beginnen.
Puur lood

De hoge weerstand van lood tegen water- en atmosferische corrosie is een bekend feit. Het corrodeert niet ik leid en wanneer in de grond. Maar als het water veel koolstofdioxide bevat, dan lost het lood erin op, omdat er loodbicarbonaat wordt gevormd, dat al oplosbaar is.
Over het algemeen is lood zeer goed bestand tegen neutrale oplossingen, matig bestand tegen alkalische oplossingen, evenals tegen sommige zuren: zwavelzuur, fosforzuur, chroomzuur en zwavelzuur. Met geconcentreerd zwavelzuur (vanaf 98%) bij een temperatuur van 25°C kan lood langzaam oplossen.
Waterstoffluoride met een concentratie van 48% lost lood op bij verhitting. Lood reageert sterk met zoutzuur en salpeterzuur, met mierenzuur en azijnzuur. Zwavelzuur zal het lood bedekken met een enigszins oplosbare laag loodchloride (PbCl2) en verder oplossen zal niet plaatsvinden. In geconcentreerd salpeterzuur zal het lood ook bedekt zijn met een laagje zout, maar verdund salpeterzuur zal het lood oplossen. Chloriden, carbonaten en sulfaten zijn niet agressief ten opzichte van lood, terwijl nitraatoplossingen het tegenovergestelde zijn.
Puur titaan

Goede corrosieweerstand is een kenmerk van titanium.Het wordt niet geoxideerd door sterke oxidatiemiddelen, is bestand tegen zoutoplossingen, FeCl3, enz. Geconcentreerde minerale zuren veroorzaken corrosie, maar zelfs kokend salpeterzuur in een concentratie van minder dan 65%, zwavelzuur - tot 5%, zoutzuur - tot 5% - veroorzaakt geen corrosie van titanium. Normale corrosiebestendigheid tegen basen, alkalische zouten en organische zuren onderscheidt titanium van andere metalen.
Zuiver zirkonium

Zirkonium is beter bestand tegen zwavelzuur en zoutzuur dan titanium, maar minder bestand tegen aquaregia en nat chloor. Het heeft een hoge chemische weerstand tegen de meeste basen en zuren, bestand tegen waterstofperoxide (H2O2).
De werking van bepaalde chloriden, kokend geconcentreerd zoutzuur, koningswater (een mengsel van geconcentreerd salpeterzuur HNO3 (65-68 gew.%) en zoutoplossing HCl (32-35 gew.%), heet geconcentreerd zwavelzuur en rokend salpeterzuur-oorzaak Met betrekking tot corrosie is dit zo'n eigenschap van zirkonium als hydrofobiciteit, dat wil zeggen dat dit metaal niet wordt bevochtigd door water of waterige oplossingen.
Puur tantaal

De uitstekende chemische weerstand van tantaal is vergelijkbaar met die van glas. De dichte oxidefilm beschermt het metaal bij temperaturen tot 150 ° C tegen de werking van chloor, broom, jodium. De meeste zuren werken onder normale omstandigheden niet in op tantaal, zelfs aquaregia en geconcentreerd salpeterzuur veroorzaken geen corrosie. Alkalische oplossingen hebben praktisch geen effect op tantaal, maar waterstoffluoride werkt erop en geconcentreerde hete alkalische oplossingen worden gebruikt, alkalische smelten worden gebruikt om tantaal op te lossen.
