Wat is het verschil tussen grafeen en grafiet?
Koolstof is een opmerkelijk chemisch element en staat handig op nummer 6 in de veertiende groep van de tweede periode van het periodiek systeem van chemische elementen. Sinds de oudheid kennen mensen diamant en grafiet, twee van de meer dan negen allotrope modificaties van dit element die tot nu toe zijn ontdekt. Trouwens, het is koolstof dat in vergelijking met andere stoffen het grootste aantal allotrope modificaties heeft dat de moderne wetenschap kent.
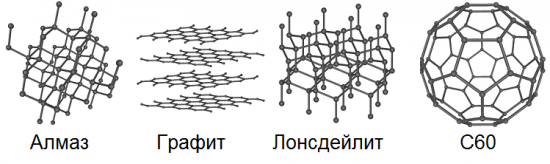
Allotropie impliceert de mogelijkheid van het bestaan in de natuur van hetzelfde chemische element in de vorm van twee of meer eenvoudige stoffen, de zogenaamde allotrope vormen of allotrope modificaties, die verschillen in deze stoffen veroorzaken, zowel in structuur als in eigenschappen. Koolstof heeft dus 8 van dergelijke basisvormen: diamant, grafiet, lonsdaleiet, fullerenen (C60, C540 en C70), amorfe koolstof en enkelwandige nanobuis.
Onder deze vormen van koolstof zijn er totaal verschillende eigenschappen en karakter: zachte en harde, transparante en ondoorzichtige, goedkope en dure stoffen. Laten we echter twee vergelijkbare koolstofmodificaties vergelijken: grafiet en grafeen.

We zijn allemaal bekend met graffiti sinds school.De vulling van een gewoon potlood is precies grafiet. Het is vrij zacht, glad en vettig om aan te raken, de kristallen zijn platen, de atoomlagen bevinden zich boven elkaar, dus bij het wrijven, bijvoorbeeld op papier, kunnen individuele vlokken van de gelaagde kristalstructuur van grafiet gemakkelijk loslaten , waardoor een karakteristiek donker spoor op het papier achterblijft.
Grafiet geleidt elektrische stroom goed, de weerstand is gemiddeld 11 Ohm * mm2 / m, maar de geleidbaarheid van grafiet is niet hetzelfde vanwege de natuurlijke anisotropie van zijn kristallen. De geleidbaarheid langs de vlakken van het kristal is dus honderden keren hoger dan de geleidbaarheid in deze vlakken. De dichtheid van grafiet is van 2,08 tot 2,23 g / cm3.
In de natuur wordt grafiet bij hoge temperaturen gevormd in stollings- en vulkanisch gesteente, in skarns en pegmatieten. Het komt voor in kwartsaders met mineralen in hydrothermische polymetallische afzettingen van gemiddelde temperatuur. Het is wijd verspreid in metamorfe gesteenten.
Zo zijn sinds 1907 's werelds grootste reserves van natuurlijk vlokgrafiet ontwikkeld op het eiland Madagaskar. Het eiland bestaat uit Precambrische metamorfe gesteenten die naar de oppervlakte stijgen in een bergachtig terrein met hypsometrische markeringen van 4.000-4.600 voet. Het grafiet wordt hier gevonden in een gordel van 400 mijl lang en domineert de bergen in het oostelijke deel van het centrum van het eiland.
Grafeen heeft, in tegenstelling tot grafiet, geen bulkkristalstructuur; het heeft een tweedimensionaal zeshoekig kristalrooster, slechts één atoom dik. Bij zo'n allotrope modificatie komt koolstof helemaal niet van nature voor, maar kan het theoretisch kunstmatig worden verkregen. We kunnen zeggen dat een vlak dat opzettelijk is gescheiden van de meerlagige bulkkristalstructuur van grafiet, precies dit grafeen zal zijn.
Wetenschappers waren aanvankelijk niet in staat om grafeen te verkrijgen in de vorm van een eenvoudige tweedimensionale film, vanwege de instabiliteit van materie in deze vorm. Op een substraat van siliciumoxide (door de binding met de diëlektrische laag) was het echter nog steeds mogelijk om grafeen van één atoom dik te verkrijgen: in 2004 publiceerden de Russische wetenschappers Andrey Geim en Konstantin Novoselov van de Universiteit van Manchester een rapport in Science om op deze manier grafeen te verkrijgen.
En zelfs vandaag de dag zijn dergelijke eenvoudige methoden om grafeen voor onderzoek te verkrijgen, zoals mechanische afschilfering van een koolstofmonolaag van een bulkgrafietkristal met behulp van plakband (en vergelijkbare methoden), gerechtvaardigd.
De onderzoekers denken dat dankzij hun vooruitgang binnenkort een nieuwe klasse van op grafeen gebaseerde nano-elektronica zal verschijnen, waar veldeffecttransistors minder dan 10 nm dik zullen zijn. Feit is dat de mobiliteit van elektronen in grafeen zo hoog is (10.000 cm2/V*s) dat het vandaag het meest veelbelovende alternatief voor conventioneel silicium lijkt te zijn.
Hoge draaggolfmobiliteit is het vermogen van elektronen en gaten om extreem snel te reageren op het effect van aangelegde elektrische velden, en dit is buitengewoon belangrijk voor veldeffecttransistors, de fundamentele bedieningseenheid van moderne elektronica.
Er zijn ook vooruitzichten voor de creatie van verschillende biologische en chemische sensoren, evenals dunne films voor fotovoltaïsche apparaten en aanraakschermen. Ondanks dit alles is de thermische geleidbaarheid van grafeen 10 keer hoger dan die van koper, en dit criterium is altijd erg belangrijk voor elektronica.